Bildnachweis: R – stock.adobe.com , stock3.com.
Das belgische Medizintechnikunternehmen Nyxoah hat von der US-amerikanischen Food and Drug Administration (FDA) die Zulassung für sein Genio-System erhalten. Damit darf die Technologie erstmals auch in den USA vermarktet werden – einem der weltweit größten Märkte für medizintechnische Innovationen. Der Schritt gilt als wichtiger Meilenstein, da Nyxoah nun regulatorische Planungssicherheit für den Eintritt in diesen Markt gewonnen hat. Von Urs Moesenfechtel
Versorgungslücke für bestimmte Patientengruppen
Die obstruktive Schlafapnoe (OSA) gehört zu den häufigsten schlafbezogenen Atmungsstörungen und kann das Risiko für Herz-Kreislauf-Erkrankungen deutlich erhöhen. Besonders schwierig ist die Behandlung von Patienten mit vollständigem konzentrischem Kollaps (CCC) der oberen Atemwege – einer anatomischen Ausprägung, bei der sich die Atemwege während des Schlafs ringförmig verschließen. Für diese Gruppe gab es in den USA bislang keine zugelassene neurostimulative Therapieoption. Das Genio-System setzt genau hier an: Es stimuliert den Zungennerv beidseitig, kommt ohne implantierte Batterie aus, ist MRT-kompatibel und kann ohne weiteren chirurgischen Eingriff technisch aufgerüstet werden. Zugelassen ist es für Patienten mit mittelschwerer bis schwerer OSA und einem Apnoe-Hypopnoe-Index (AHI) zwischen 15 und 65. Die Zulassung basiert auf den Ergebnissen der multizentrischen, prospektiven DREAM-Studie. Diese erreichte sowohl den primären als auch den sekundären Endpunkt: Eine AHI-Responder-Rate von 63,5 %, eine ODI-Responder-Rate von 71,3 % sowie eine mediane AHI-Reduktion um 70,8 %. Bei 82 % der Teilnehmer sank der AHI auf unter 15. Hervorgehoben wird die positionsunabhängige Wirksamkeit: Selbst in Rückenlage – einer Position, in der sich Atemwegsobstruktionen häufig verdoppeln – lag die mediane AHI-Reduktion bei 66,6 %, im Vergleich zu 71,0 % bei Patienten in Nicht-Rückenlage.
Hier finden Sie weitere Beiträge der Plattform Life Sciences zum Unternehmen.
Wettbewerbsumfeld
Mit der FDA-Entscheidung darf Nyxoah sein Genio-System nun auch in den USA bei Patienten mit mittelschwerer bis schwerer obstruktiver Schlafapnoe (OSA) vermarkten. In Europa verfügt Genio bereits seit mehreren Jahren über eine CE-Kennzeichnung für OSA und wird dort auch als einzige zugelassene Behandlungsoption bei Patienten mit vollständigem konzentrischem Kollaps (CCC) der oberen Atemwege klinisch eingesetzt, unter anderem in Deutschland. Die US-Zulassung eröffnet nun jedoch den Zugang zu einem der größten Medizintechnikmärkte der Welt, in dem CCC-Patienten bislang von allen zugelassenen neurostimulativen Therapien ausgeschlossen waren. Der bisher einzige Anbieter mit FDA-Zulassung, Inspire Medical Systems, bietet ein System an, das den Zungennerv nur einseitig stimuliert und CCC-Patienten ausdrücklich ausschließt – was bei Nyxoahs Genio-System aber nicht der Fall ist. Weitere Wettbewerber agieren vor allem außerhalb der USA oder befinden sich in früheren Entwicklungsstadien. Unternehmen wie LivaNova und Medtronic verfügen in angrenzenden Bereichen der Neurostimulation über Erfahrung, fokussieren sich derzeit jedoch nicht primär auf OSA.
Nyxoah besetzt damit in den USA eine Nische, die bislang unerschlossen war – eine Ausgangsposition, die in einem stark regulierten Marktumfeld strategische Vorteile bietet. Die FDA-Zulassung stützte sich auf die Ergebnisse der zulassungsrelevanten DREAM-Studie. Zusätzlich führt Nyxoah die noch laufende ACCCESS-Studie durch, die sich gezielt auf CCC-Patienten konzentriert und eine Nachbeobachtungszeit von fünf Jahren vorsieht. Auch wenn die FDA-Zulassung nun vorliegt, werden die bereits eingeschlossenen Patienten der ACCCESS-Studie weiterverfolgt, um umfangreiche Langzeitdaten zu Sicherheit und Wirksamkeit zu gewinnen. Diese Evidenz ist insbesondere für Erstattungsentscheidungen, die breite klinische Akzeptanz und die nachhaltige Positionierung im US-Markt von Bedeutung.
Unternehmensentwicklung und aktuelle Situation
Die FDA-Entscheidung fällt in eine Phase des Unternehmensumbaus. Im zweiten Quartal 2025 stieg der Umsatz nach vorläufigen Zahlen um 73 % auf rund 1,3 Mio. EUR, während die operativen Aufwendungen um 50 % auf etwa 20,7 Mio. EUR zunahmen. Zum Halbjahresende lagen die liquiden Mittel bei rund 43 Mio. EUR, ergänzt durch eine Kreditlinie über weitere 27,5 Mio. Euro, die an definierte Meilensteine gebunden ist. Nyxoah verlagert derzeit seine gesamte Forschung und Entwicklung nach Belgien und in die USA. Parallel zum Markteintritt muss sich Nyxoah in den USA einer Patentrechtsklage von Inspire Medical Systems stellen. Die im Mai 2025 eingereichte Klage betrifft Technologieelemente des Genio-Systems. Diese Rechtsunsicherheit könnte potenziell die zukünftige Geschäftsentwicklung beeinflussen. Das Unternehmen betont in ihrer Pressemitteilung zur FDA-Zulassung, sich in dieser Angelegenheit energisch zu verteidigen.
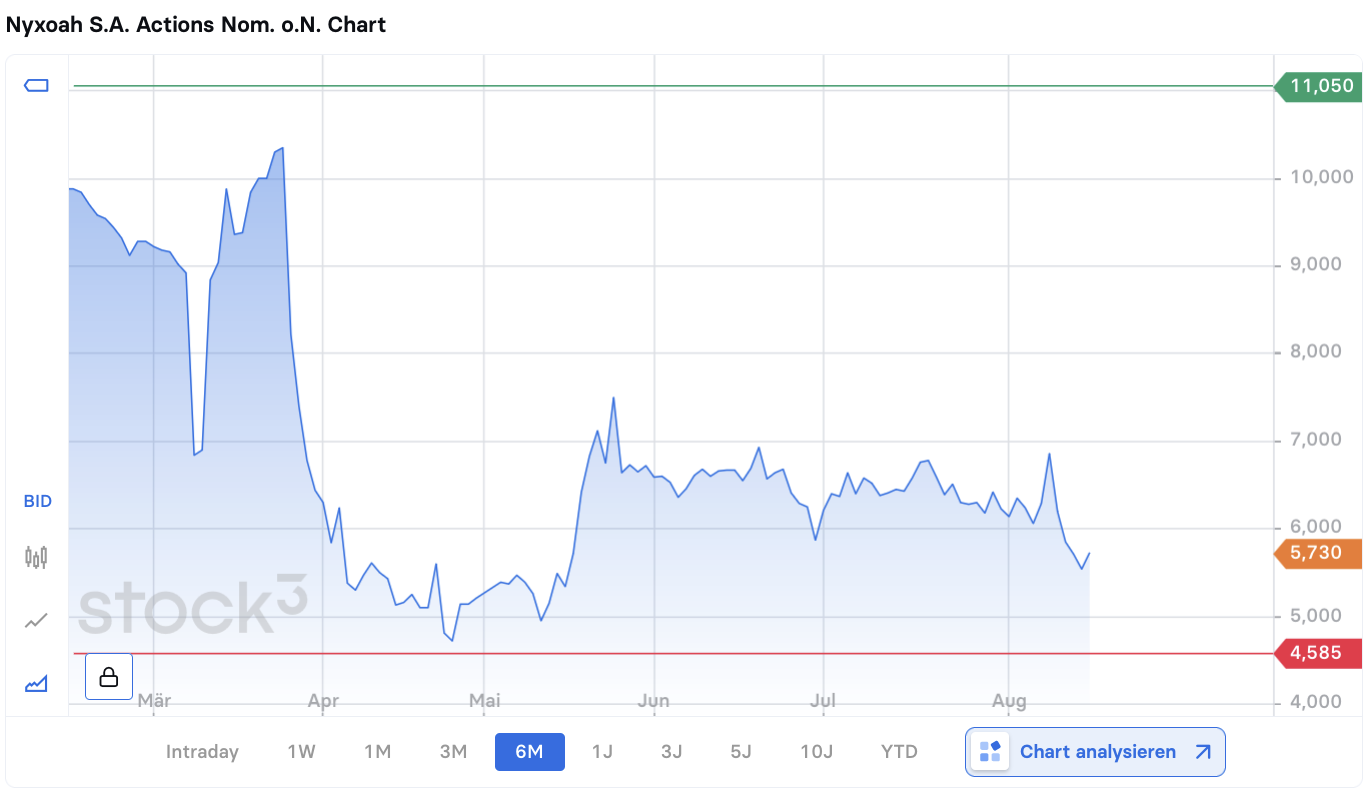
Börsennotierung und Kursentwicklung
Nyxoah ist sowohl an der Euronext Brüssel (Ticker: NYXH, ISIN: BE0974358906, WKN: A2QCWK) als auch an der Nasdaq gelistet. An der Euronext Brüssel schloss die Aktie am 14. August 2025 bei 5,74 EUR. Die Marktkapitalisierung lag zu diesem Zeitpunkt bei 214,84 Mio. Euro bei rund 37,43 Mio. ausstehenden Aktien. In den vergangenen sechs Monaten hat die Aktie an Wert verloren, nachdem sie im Frühjahr zeitweise über 9 EUR notiert hatte. Am Tag nach der FDA-Zulassung konnte sie leicht zulegen, der Kurs liegt momentan jedoch unter den Höchstständen des Jahres. Die FDA-Entscheidung könnte nun mittelfristig Impulse setzen, sobald Nyxoah die US-Markteinführung erfolgreich gestaltet.
Stimmen zur Zulassung
„Mit der Marktzulassung des Genio-Systems durch die FDA sind wir stolz darauf, diese innovative Therapie auf den US-Markt bringen zu können“, kommentierte CEO Olivier Taelman. Der Belgier steht seit 2020 an der Spitze des Unternehmens und hat in dieser Zeit vor allem die klinische Entwicklung und den Börsengang an der Nasdaq begleitet. Auch aus klinischer Sicht erhielt das Genio-System positive Resonanz. „Diese einzigartige bilaterale Stimulationstechnologie hat eine konsistente Wirksamkeit in allen Schlafpositionen, einschließlich der schwierigen Rückenlage, bei gleichzeitig ausgezeichnetem Sicherheitsprofil gezeigt“, erklärte Dr. Colin Huntley, Associate Professor an der Abteilung für Hals-Nasen-Ohren-Heilkunde und Kopf- und Halschirurgie der Thomas Jefferson University in Philadelphia. Huntley ist auf chirurgische Behandlungen bei Schlafapnoe spezialisiert und war an der klinischen Evaluierung neuer Therapieverfahren beteiligt.
Fazit
Mit der FDA-Zulassung hat Nyxoah einen lange angestrebten Meilenstein erreicht, der den Eintritt in den US-Markt ermöglicht und die Position gegenüber Wettbewerbern stärkt. Ob sich dieses Potenzial ausschöpfen lässt, hängt maßgeblich davon ab, wie schnell das Genio-System im klinischen Alltag Fuß fasst, welche Erstattungsregelungen greifen und wie überzeugend die langfristigen klinischen Ergebnisse ausfallen. Für Anleger können sich dann klare Wachstumschancen ergeben.
Autor/Autorin
Urs Moesenfechtel, M.A., ist seit 2021 Redaktionsleiter der GoingPublic Media AG - Plattform Life Sciences und für die Themenfelder Biotechnologie und Bioökonomie zuständig. Zuvor war er u.a. als Wissenschaftsredakteur für mehrere Forschungseinrichtungen tätig.




