Bildnachweis: lovelyday12 – stock.adobe.com, ITM SE, ITM SE.
Die zielgerichtete Radionuklidtherapie, auch Targeted Radionuclide Therapy (TRT) genannt, ist eine neue Form der Krebsbehandlung, die darauf abzielt, den Tumor direkt und „von innen“ zu bestrahlen und gleichzeitig die Strahlenbelastung des gesunden Gewebes zu minimieren. Von Holger Garbs
Zielgerichtete Radiopharmazeutika bestehen aus einem therapeutischen Radioisotop und einem zielgerichteten Molekül (z.B. Peptid, Antikörper, kleines Molekül), das Tumorzellen genau erkennen und an tumorspezifische Merkmale wie Rezeptoren auf der Oberfläche der Tumorzellen binden kann. Das Radioisotop reichert sich am Tumor an und zerfällt, wobei eine geringe Menge ionisierender Strahlung freigesetzt wird, die geeignet ist, Tumorgewebe zu zerstören. Dabei ermöglicht die hochpräzise Lokalisierung eine gezielte Behandlung mit potenziell minimalen Auswirkungen auf das umliegende gesunde Gewebe.
Zielgerichtete Radionuklidtherapie in Deutschland: regionaler Start, globale Wirkung
Die zielgerichtete Radionuklidtherapie ist eine innovative Form der Krebsbehandlung, die jedoch bereits seit 25 Jahren klinisch erforscht wird. In Deutschland wurde sie erstmals 1997 von Prof. Dr. Richard P. Baum, dem heutigen Präsidenten der International Centers for Precision Oncology Foundation (ICPO), im Rahmen eines klinischen Heilversuchs am Universitätsklinikum Frankfurt angewendet.
Im Jahr 2022 ist die zielgerichtete Radionuklidtherapie eine aussichtsreiche Technologie in der Präzisionsonkologie mit mittlerweile zehn zugelassenen Therapeutika. Derzeit werden verschiedene klinische Studien zu dieser Therapieform durchgeführt, die Erkenntnisse für besonders schwer zu behandelnde Krebsindikationen liefern sollen. Während weltweit an der Radionuklidtherapie geforscht wird, ist Deutschland nach wie vor einer der Vorreiter in diesem Bereich. Die in München ansässige ITM Isotope Technologies Munich SE (ITM) gilt als eines dieser führenden Biotechunternehmen, die sich der Entwicklung einer neuen Generation präziser Radiotherapeutika und -diagnostika verschrieben haben, um die Behandlungsmöglichkeiten für Krebspatienten weltweit zu erweitern und zu verbessern.
Zielgerichtete Radionuklidtherapie und Theranostik
Obwohl in den letzten zehn Jahren Fortschritte bei der Behandlung von Krebs erzielt wurden, zählt die Erkrankung nach wie vor zu den häufigsten Todesursachen weltweit. Eine wesentliche Herausforderung besteht darin, Krebszellen wirksam zu bekämpfen, ohne gesunde Zellen zu schädigen und den Patienten schweren Nebenwirkungen auszusetzen.
Hier setzt die Radionuklidtherapie an. Sie ist darauf ausgerichtet, Krebszellen sehr gezielt und mit potenziell minimalen Auswirkungen auf das umliegende gesunde Gewebe zu bekämpfen. Das Konzept der Radionuklidtherapie kann dabei sowohl zur Behandlung als auch für eine präzise Diagnose eingesetzt werden. Beide Vorgänge basieren auf dem gleichen Wirkprinzip: Ein tumorspezifisches Zielmolekül schleust ein medizinisches Radioisotop zum Tumor, damit es dort zielgerichtet eine geringe Menge ionisierender Strahlung abgeben kann. Der diagnostische und der therapeutische Kandidat unterscheiden sich dabei lediglich in der Art des Radioisotops. Die Kombination von Therapie und Diagnostik wird in der Fachsprache „Theranostik“ genannt und kann insbesondere für die Behandlung von aggressiven Krebsarten von Vorteil sein.
Ein Blick in die Geschichte
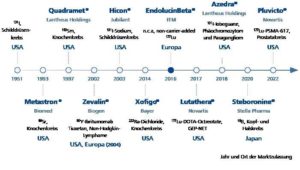
In den letzten zehn Jahren wurde eine Reihe von Radiotherapeutika zugelassen, die zunehmend zu einem festen Bestandteil der Patientenversorgung werden. Der erste dokumentierte Einsatz eines Radiopharmazeutikums geht auf das Jahr 1941 zurück, als Jod-131 im Rahmen eines Heilversuchs als letzte Behandlungsoption bei einem Patienten mit Schilddrüsenkrebs eingesetzt wurde. Jod-131 wurde zehn Jahre später von der US-amerikanischen Arzneimittelbehörde Food and Drug Administration (FDA) als erstes Radiotherapeutikum zugelassen. Es dauerte weitere 42 Jahre, bis 1993 ein weiteres Medikament, Strontium-89-Chlorid (Metastron) von BioMed, zur Behandlung von Schmerzen bei Knochenmarksmetastasen zugelassen wurde. Seitdem erhielten acht weitere Radiotherapeutika für verschiedene Krebsindikationen die Marktzulassung, zuletzt im März 2022 das von Novartis entwickelte 177Lu-PSMA-617 (Pluvicto) für die Behandlung von metastasiertem Prostatakrebs. Das deutsche Biotechunternehmen ITM ist seit Langem ein Zulieferer von non-carrier-added (n.c.a) Lutetium-177, der Kernkomponente dieses und weiterer Radiotherapeutika.

Während bei den ersten Radiotherapeutika noch medizinische Radioisotope ohne Zielmoleküle Einsatz fanden, wurden bei später entwickelten Radiopharmazeutika zunehmend medizinische Radioisotope mit zielgerichteten Molekülen gekoppelt. Diese Zielmoleküle erkennen tumorspezifische Merkmale wie Rezeptoren auf der Oberfläche der Tumorzellen und binden an diese, was eine besonders gezielte Anreicherung der medizinischen Strahlung in den Tumorzellen ermöglicht.
Die Radionuklidtherapie ist eine vielversprechende Behandlungsoption, die vor allem in den letzten Jahren vermehrt in den Fokus rückt, sich schnell weiterentwickelt und konstant verbessert wird. Da die Zahl der Zulassungen für Radiopharmazeutika und Radioisotope (als Ausgangsstoffe von Radiopharmazeutika) stetig steigt, hat die zielgerichtete Radionuklidtherapie das Potenzial, demnächst zu einem neuen Standard im therapeutischen und diagnostischen Arsenal der Präzisionsonkologie zu werden. Sie ist konzipiert, eine präzise, zielgerichtete Strahlentherapie mit hoher Wirksamkeit und Sicherheit zu kombinieren, und daher ein wichtiges Thema in der klinischen Forschung und Entwicklung.
Historische Entwicklung der Radionuklidtherapie
- 1941: Auftakt der zielgerichteten Radionuklidtherapie: erste Anwendung von radioaktivem Jod (Jod-131) im Rahmen eines Heilversuchs zur Diagnostik und Behandlung von Schilddrüsenkrebs
- 1951: Erste Zulassung eines Radiotherapeutikums durch die FDA: Jod-131 zur Behandlung von Schilddrüsenkrebs
- 1997: Erste Radionuklidtherapie in Deutschland, Frankfurt am Main, durch Prof. Dr. Richard P. Baum für die Behandlung eines Patienten mit neuroendokrinem Tumor (NET) im Rahmen eines Heilversuchs (Anwendung eines nicht-zugelassenen Medikaments)
- 2013: Erste Radionuklidtherapie im Bereich Prostatakrebs weltweit durch Prof. Dr. Baum in Bad Berka: Behandlung eines Patienten mit Lutetium-177-PSMA im Rahmen eines Heilversuchs
- 2017: Durchführung der 5.000. Radionuklidtherapie in Bad Berka, Behandlung eines NET-Patienten aus den USA
- 2019: Als erster europäische Mediziner erhält Prof. Dr. Baum den Saul Hertz Award auf der Jahrestagung der SNMMI
Aktuelle Entwicklungen und der Weg in die Zukunft
Diagnostische und therapeutische Radioisotope bieten eine vielversprechende Plattform für die Entwicklung innovativer Arzneimittel, die eine nicht-invasive Visualisierung von Tumoren und eine entsprechende Behandlung ermöglichen. Die zielgerichtete Radionuklidtherapie hat einen Innovationsschub in der Nuklearmedizin ausgelöst und die Nachfrage nach hochwertigen Radioisotopen und Radiopharmazeutika gesteigert.
Aktuell werden verschiedene Ansätze der Radionuklidtherapie in klinischen Studien untersucht. Die ersten Ergebnisse und Zulassungen haben für Schlagzeilen gesorgt. Als einer der Pioniere in diesem Bereich führt ITM auf Basis positiver Phase-II-Daten aktuell zwei klinische Phase-III-Studien durch, in denen der Lead-Kandidat ITM-11 (n.c.a.-Lutetium-177-Edotreotid) für die Behandlung von neuroendokrinen Tumoren gastroenteropankreatischen Ursprungs (GEP-NETs) untersucht wird.
Autor/Autorin
Die Redaktion der Kapitalmarkt Plattform GoingPublic (Magazin, www.goingpublic.de, LinkedIn Kanal, Events) widmet sich seit Dezember 1997 den aktuellen Trends rund um die Finanzierung über die Börse. Ob Börsengang (GoingPublic) oder die vielfältigen Herausforderungen für börsennotierte Unternehmen (Being Public), präsentiert sich GoingPublic cross-medial als Kapitalmarktplattform für Emittenten und Investment Professionals.




