Bildnachweis: Immunic Inc..
Immunic, Inc (www.imux.com) hat gestern positive Daten aus der Erhaltungsphase seiner Phase-2b-Studie CALDOSE-1 mit dem Leitwirkstoff Vidofludimus calcium (IMU-838) bei Patienten mit mittelschwerer bis schwerer Colitis ulcerosa (UC) bekannt gegeben.
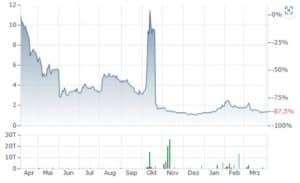
Kurz nach der Meldung zog der Aktienkurs um bis zu 27% auf 1,85 USD an, der Schlusskurs gestern Abend lag noch bei 1,55 USD (+6%).
Dabei zeigten die Maintenance Daten der CALDOSE-1-Studie mit Vidofludimus Calcium in UC-Patienten einen dosislinearen Anstieg der klinischen Remission im Vergleich zu Placebo nach Woche 50.
Darüber hinaus bestätigte eine explorative statistische Analyse, dass die 30-mg-Dosis von Vidofludimus Calcium hinsichtlich des Erreichens der klinischen Remission nach Woche 50 statistisch signifikant war (p=0,0358), mit einer absoluten Verbesserung von 33,7% gegenüber Placebo.
Zudem wurde ein dosislinearer Anstieg der endoskopischen Heilung beobachtet, wobei die 30-mg-Dosis von Vidofludimus Calcium eine absolute Verbesserung von 37,8% gegenüber Placebo zeigte und in einer explorativen statistischen Analyse ebenfalls statistische Signifikanz erreichte (p=0,0259).
Immunic ist der Ansicht, dass die Daten aus der Maintenance Phase von CALDOSE-1 die Aktivität von Vidofludimus Calcium ohne chronische Kortikosteroid-Verabreichung bestätigen.
In Übereinstimmung mit früheren Datensätzen in anderen Patientenpopulationen erwies sich die Verabreichung von Vidofludimus Calcium in der Maintenance Phase dieser Studie als sicher und gut verträglich. Es wurden keine neuen Sicherheitssignale beobachtet.
Die Häufigkeit von behandlungsbedingten unerwünschten Ereignissen (treatment-emergent adverse events) war sowohl in der 10-mg- als auch in der 30-mg-Dosisgruppe von Vidofludimus Calcium mit Placebo vergleichbar. Im Vergleich zu Placebo gab es keine erhöhten Raten von Leberereignissen, Leberenzymen, Nierenereignissen oder unerwünschten Ereignissen von besonderem Interesse. Zudem wurden keine Hy’s Law-Fälle beobachtet.
CEO Dr. Daniel Vitt: „Diese beeindruckenden Ergebnisse aus der Maintenance Phase unserer CALDOSE-1-Studie in Patienten mit UC sind äußerst ermutigend, da sie eine statistisch signifikante Aktivität von Vidofludimus Calcium im Vergleich zu Placebo zeigen. Wir glauben, dass diese Daten im Vergleich zu verfügbaren Maintenance Daten für andere UC-Medikamente vorteilhaft sind. Obwohl wir nicht beabsichtigen, die Phase-3-Entwicklung von Vidofludimus Calcium in UC aus eigener Kraft und ohne zusätzliche Finanzierung und Ressourcen zu starten, werden wir auf der Grundlage dieses positiven Ergebnisses verschiedene Optionen für unser UC-Programm sowie andere Indikationen der chronisch-entzündlichen Darmerkrankungen prüfen.“
Chief Medical Officer Dr. Andreas Muehler: „Die Ergebnisse der Maintenance Phase unserer CALDOSE-1-Studie bestätigen frühere Beobachtungen in der Induktionsphase, dass Vidofludimus Calcium im Vergleich zu Placebo bei UC-Patienten, die keine Kortikosteroide gleichzeitig einnehmen, einen Vorteil in Bezug auf die klinische Remission bietet. Die chronische Verabreichung von Kortikosteroiden ist in der klinischen Praxis aufgrund medizinisch relevanter, gut dokumentierter Nebenwirkungen unerwünscht. Daher könnten zukünftige klinische Studien mit Vidofludimus Calcium problemlos ohne gleichzeitige Steroidanwendung durchgeführt werden. Wir freuen uns auch, dass die Studiendaten erneut das sehr günstige Sicherheits- und Verträglichkeitsprofil von Vidofludimus Calcium bestätigen, das bereits in anderen Studien beobachtet wurde.“
Jahres-Chart:
Immunic, Inc. ist ein Biotechnologieunternehmen, das eine klinische Pipeline von oral verabreichten, niedermolekularen Therapien für chronische Entzündungs- und Autoimmunerkrankungen entwickelt. Das führende Entwicklungsprogramm des Unternehmens, Vidofludimus Calcium (IMU-838), das sich derzeit in klinischen Phase-3-Studien zur Behandlung von Multipler Sklerose befindet, hemmt selektiv aktivierte Immunzellen und zeigt kombinierte entzündungshemmende, antivirale und neuroprotektive Wirkungen. IMU-856 zielt darauf ab, die intestinale Barrierefunktion wiederherzustellen und das Darmepithel zu regenerieren, was bei zahlreichen Magen-Darm-Erkrankungen wie Zöliakie anwendbar wäre, wo es derzeit in einer klinischen Proof-of-Concept-Studie untersucht wird.
Die Aktie notiert an der NASDAQ. Aktuelle Marktkapitalisierung: 69 Mio. USD
Immunic erhält frisches Eigenkapital über 60 Mio. USD – (goingpublic.de)
Autor/Autorin
Ike Nünchert ist Mitglied des Autoren-Teams und schreibt für GoingPublic On- & Offline-News rund ums Börsengeschehen schwerpunktmäßig in Europa und den USA. Ein weiterer Berichtsfokus liegt beim Segment gründergeführter börsennotierter Unternehmen.




