Eine neue Art von Arzneimitteln verändert derzeit die Art und Weise, wie Krankheiten behandelt, ja gar geheilt werden können. Es handelt sich um Gen- und Zelltherapien, die nach Jahrzehnten der Entwicklung nun allmählich in die Gesundheitsversorgung Eingang finden. Und trotz der bislang erstaunlichen Erfolge gibt es kritische Stimmen: zu teuer, zu wenige Daten, zu unsicher, zu elitär. Fährt der Zug dieser innovativen Therapien an Deutschland vorbei?

Vor 25 Jahren befand sich das Gebiet der Gen- und Zelltherapien noch in seinen Anfängen und stand vor zahlreichen technischen wie auch wissenschaftlichen Herausforderungen. Die effiziente Einführung von Genen in Zielzellen war schwierig, denn es mangelte an effektiven Transportmitteln für die Erbinformationen, den sogenannten Vektoren. Auch das Verständnis der Genregulation und der langfristigen Auswirkungen war begrenzt. Trotz dieser technischen Herausforderungen begannen in den späten 1990er-Jahren die ersten klinischen Studien. In dieser Zeit gab es auch Rückschläge. Die technologischen Herausforderungen und die Notwendigkeit, Sicherheitsbedenken anzugehen, begrenzten zudem die Fortschritte. Dennoch legten die Forschungen und Experimente in dieser Zeit den Grundstein für die beeindruckenden Erfolge, die wir derzeit in diesem Bereich sehen.

Die innovativen Prinzipien, die heute in der Patientenversorgung eingesetzt werden, zielen darauf ab, genetische und zelluläre Defekte auf molekularer Ebene zu behandeln. Diese neuartigen Therapieansätze werden in Europa unter dem Begriff der Advanced Therapy Medicinal Products (ATMPs; siehe hierzu Abb. 1) zusammengefasst und werden seit dem Jahr 2008[1] zentral von der Europäischen Arzneimittelagentur (EMA) für alle Mitgliedstaaten der Europäischen Union reguliert. Derzeit werden EU-weit 14 Gentherapeutika, zwei Zelltherapeutika sowie zwei biotechnologisch bearbeitete Gewebeprodukte mit einer zentralen EU-Zulassung in der Versorgung eingesetzt, 15 davon als Arzneimittel gegen seltene Leiden (Orphan Drugs).
In Deutschland ist es möglich, Patientinnen und Patienten über die Genehmigung von nicht routinemäßig hergestellten ATMPs nach § 4b Arzneimittelgesetz (AMG) unter den dort genannten Bedingungen mit solchen Produkten auch ohne EU–Zentralzulassung zu versorgen. Das Paul–Ehrlich–Institut als zuständige Zulassungsbehörde weist in dieser Kategorie für Deutschland ein somatisches Zelltherapeutikum sowie sechs biotechnologisch bearbeitete Gewebeprodukte aus.
Studienlandschaft und Marktwachstum
Im Jahr 2022 wurden fünf neue Zell- und Gentherapien von der US–amerikanischen Zulassungsbehörde FDA zugelassen, für die nächsten Jahre sind bereits mehr als 50 weitere In–vivo und Ex-vivo Zell- und Gentherapieprodukte geplant. Nach Angaben der Alliance for Regenerative Medicine (ARM) laufen weltweit rund 2.400 klinische Studien im Bereich der regenerativen Medizin, von denen 1.129 von der Industrie gesponsert werden und von denen sich 222 in Phase III befinden.
Fast 1.200 Zelltherapien und mehr als 1.240 Gentherapien waren im Jahr 2021 in der präklinischen Entwicklung, weitere 625 bzw. 520 in klinischen Studien. Die Erfahrungen zeigen allerdings, dass nur ein geringer Anteil dieser Forschungskandidaten eine Marktreife erreichen wird. Die Studienlandschaft deutet darauf hin, dass sich der Schwerpunkt von seltenen monogenen Krankheiten und Flüssigtumoren auf komplexere Krankheiten und Krebserkrankungen mit soliden Tumoren sowie auf weiter verbreitete Krankheiten (z.B. Erkrankungen des Bewegungsapparats, Diabetes, ZNS- und Herz-Kreislauf-Erkrankungen) verlagert. Studienergebnisse deuten auch darauf hin, dass Gentherapien als frühere Behandlungsmethoden und nicht nur als letzte Hoffnung eingesetzt werden könnten.
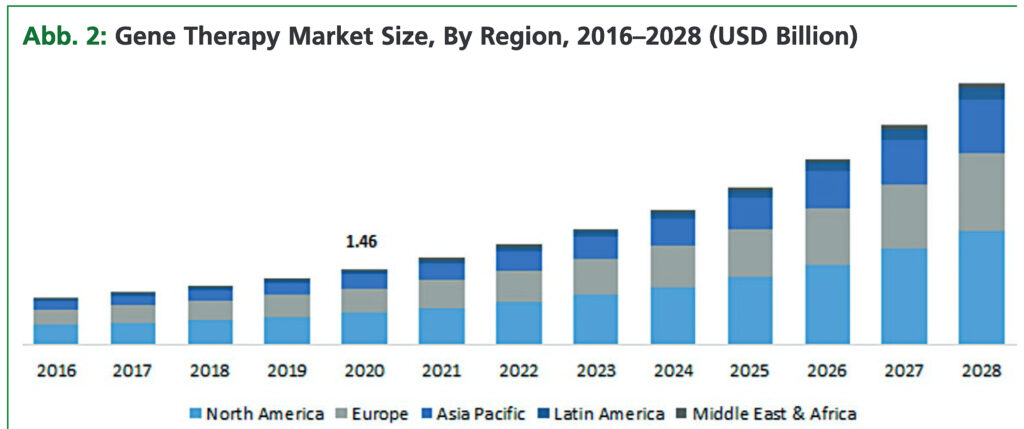
Pharma- sowie Biotechnologieunternehmen und Risikokapitalgeber haben erhebliche Mittel in die Entwicklung von Gen- und Zelltherapien investiert. In der jüngsten Vergangenheit haben viele Unternehmen Partnerschaften geschlossen und Finanzierungsrunden durchgeführt, um die Forschung und Entwicklung voranzutreiben, denn der Markt für Gen- und Zelltherapien ist in den letzten Jahren stark gewachsen. Schätzungen zufolge könnte der Gesamtmarkt bis 2030 einen Wert von mehr als 10 Mrd. USD erreichen, abhängig von der Entwicklung und Zulassung neuer Therapien[2].
Auf dem Weg zur Entwicklung einer nationalen Strategie für Gen- und Zelltherapien
Das Bundesforschungsministerium (BMBF) hat 2022 das an der Charité angesiedelte Berlin Institute of Health (BIH) beauftragt, die Entwicklung einer nationalen Strategie für Gen und Zelltherapien voranzutreiben und zu koordinieren. Dazu sind nach mehreren Iterationsrunden mit den Stakeholdern acht Handlungsfelder identifiziert worden. Ab Oktober 2023 erfolgt durch Arbeitsgruppen die konkrete Ausgestaltung inkl. Maßnahmenkatalogen für die jeweiligen Handlungsfelder. Das Dokument mitsamt Umsetzungsplan soll Mitte 2024 veröffentlicht werden.
Die pharmazeutische Industrie, die über ihre Verbände auch am Prozess beteiligt ist, unterstützt diese Maßnahmen tatkräftig. Sie kommen nämlich keine Minute zu früh: Das hochinnovative und zukunftsträchtige Themengebiet der Gen- und Zelltherapien muss dringend ausgebaut werden, soll Deutschland nicht völlig den Anschluss an die Spitze (derzeit USA und China) verlieren.
Dringender Handlungsbedarf
Ein effektives Monitoring aktueller Forschungsansätze ist essenziell. Hierbei könnte eine Datenbank, die auf bereits bestehenden Grundlagen aufbaut, laufende Forschungsprojekte im Bereich der Gen- und Zelltherapien erfassen. Ebenso wäre eine Datenbank für aktuelle klinische Studien von großer Bedeutung.
Die Bündelung der vorhandenen Wissenschaftskompetenz stellt einen weiteren wichtigen Aspekt dar. Eine verstärkte Vernetzung, sowohl auf nationaler als auch auf internationaler Ebene, zwischen bisher parallel agierenden Forschungsstrukturen wie Universitätsmedizin, Deutschen Zentren der Gesundheitsforschung, Stiftungen, Fraunhofer-Gesellschaft und Leibniz-Gemeinschaft könnte Synergien schaffen und die Fortschritte beschleunigen. Die Förderung wissenschaftlicher Exzellenz sollte zudem eine Verbindung zwischen grundlagen- und anwendungsorientierter Forschung herstellen und Clinical-Scientist-Programme unterstützen, um die Umsetzung von Forschungsergebnissen in die klinische Praxis zu fördern.
Im Bereich der kommerziellen und industriellen Anwendung sind verschiedene Maßnahmen von Relevanz. Eine engere Verzahnung zwischen Zulassungsbehörden und Initiatoren klinischer Studien sollte Prozesse optimieren. Die Anpassung des Regulierungsrahmens könnte dabei helfen, Genehmigungsverfahren zu harmonisieren und zu beschleunigen. Die finanzielle Unterstützung bei der Patentierung und Kommerzialisierung geistigen Eigentums sowie die Förderung des Venture-Capital-Markts triebe die wirtschaftliche Entwicklung voran.
Aber auch die Produktion von Gen- und Zelltherapien muss angegangen werden. Die Förderung von Education-Programmen im Bereich der Guten Herstellungspraxis (GMP) sicherte die Produktionsqualität. Eine Beseitigung regulatorischer Hürden steigerte die Effizienz. Gleichzeitig wäre eine Förderung von Kapazitätserweiterungen notwendig, um die steigende Nachfrage zu bewältigen. In Bezug auf Lieferketten wäre eine Netzwerkbildung innerhalb der Produktionstechnik von Biotechnologie, Maschinenbau, IT und Grundstoffchemie von Bedeutung.
Schließlich bleibt die Verfügbarkeit von Gen- und Zelltherapien in der Gesundheitsversorgung ein zentrales Anliegen. Die Ansprache von Entscheidungsträgern wie Bundesministerium für Gesundheit, Gemeinsamer Bundesausschuss, Krankenkassen und der Politik, um den Zugang zu diesen Therapien zu erhalten oder zu verbessern, ist unerlässlich. Die Entwicklung innovativer Erstattungsmodelle trüge sicherlich dazu bei, die Verbreitung und Nutzbarkeit dieser zukunftsträchtigen Behandlungsmöglichkeiten noch besser sicherzustellen.
[1] Für die Europäische Union wurde vom Europäischen Parlament und vom Rat die Verordnung (EG) Nr. 1394/2007 über Arzneimittel für neuartige Therapien verabschiedet. Sie findet seit dem 30. Dezember 2008 unmittelbar in den EU–Mitgliedstaaten Anwendung.
[2] https://www.polarismarketresearch.com/industry-analysis/gene-therapy-market






