„Die Revolution in der Krebstherapie“, so wird in vielen Tageszeitungen und Analystenreports die Entwicklung der sogenannten Checkpoint-Inhibitoren und ihre Einführung in die klinische Behandlungspraxis verschiedener Krebsarten bezeichnet. In der Tat können bei bestimmten Krebsarten durch den Einsatz von Antikörpern, die sozusagen gegen die „Bremsen“ des eigenen Immunsystems gerichtet sind, zum Teil spektakuläre Behandlungserfolge erzielt werden. Von Dr. Claus Kremoser und Thomas Hoffmann
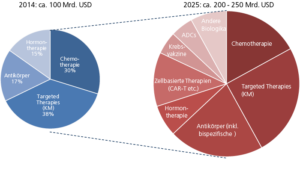
Das Aufsehenerregende an diesen neuen „Cancer Biologicals“ ist vor allem der – wenn auch kleine Anteil – von Komplettremissionen. Diese „Krebsheilung“ selbst bei vorhandenen Metastasen kannte man von bisherigen Therapieformen bislang nicht. Diese großartigen Erfolge werden zu einem – im wörtlichen Sinne – hohen Preis von 100 bis 150.000 USD pro Antikörper und Jahr erkauft: Bei einer Kombinationstherapie von zwei oder mehr Cancer Biologicals addieren sich die Kosten. Doch mit den teuren Antikörpern ist keineswegs die Spitze bei den Therapiekosten erreicht: Von den sich gerade in der Zulassung befindlichen CAR-T-Zelltherapien, die aufwendig patienteneigene T-Zellen so verändern, dass sie den Tumor aggressiv attackieren können, wird erwartet, dass eine Patientenbehandlung 350 bis 700.000 USD kosten wird. Wir wollten Innovationen in der Krebsbehandlung – jetzt haben wir sie und können sie langfristig nicht für alle Patienten bezahlen. Oder doch?
Innovation in der Krebstherapie um jeden Preis?
Wenn man auf die Liste der Krebs-Blockbuster des Jahres 2016 schaut, sieht man, dass die neuen Checkpoint-Inhibitoren noch kaum zu Buche schlagen. Andererseits findet man „small molecule“-Krebstherapeutika wie Revlimid (Celge), Gleevec (Novartis) oder Velcade (J&J, Takeda), die in den Preisen und Gesamtumsätzen den Biologicals kaum nachstehen. Es gibt nur generell einen wesentlichen, gesundheitsökonomischen Unterschied zwischen den Kleinmolekülen, also synthetisch-chemisch hergestellten Medikamenten, und Biologicals: Während die Kleinmoleküle nach Ablauf des Patentes zu meist deutlich niedrigeren Preisen generisch hergestellt und vertrieben werden, ist das bei den Biologicals so leicht nicht möglich. Einen exakt gleichen Antikörper gibt es nicht und ein Biosimilar muss aufwändig entwickelt werden, was zusammen mit den gegenüber Kleinmolekülen deutlich höheren Herstellungskosten wiederum bedingt, dass es billige Biologicals-Generika nicht gibt und nicht geben wird.
Die Zukunft der Krebstherapie – teure innovative Medikamente nur für wenige Reiche?
Wenn die Preise für die innovativen Biologicals in Zukunft nicht deutlich sinken werden, wird die Krebsmedizin in Zukunft dann rationiert? Wird es die teuren, wirksamen Biologicals nur für die wohlhabenden Privatpatienten geben, während die Kassenpatienten nur „die Chemo“ bekommen? Kaum ein Gesundheitspolitiker wird derartige Fragen mit „ja“ beantworten, doch wie lautet die inhaltliche Antwort? Wir denken, dass eine Option für die Zukunft darin liegen wird, zielgerichtet Kleinmolekül-Krebstherapeutika mit innovativen Biologicals, Zell- und Virustherapien so zu kombinieren, dass gleichzeitig Therapie- und Kosteneffizienz berücksichtigt werden. Neue Kleinmolekül-Entwicklungen sollten idealerweise breit, in vielen Krebsindikationen und mit geringer Neigung zur Resistenzbildung wirken, also quasi „Breitband“-Krebstherapeutika darstellen, so wie letztlich auch die Chemotherapeutika. Also zurück zu den ungerichteten Anti-Krebswaffen mit all ihren schweren Nebenwirkungen?
Innovative Small Molecules, nebenwirkungsarm und kosteneffizient
Der Hype um die immunonkologischen Antikörper hat vergessen lassen, dass es Mechanismen und mögliche Zielstrukturen in der Onkologie gibt, die mit Kleinmolekülen bearbeitet werden können und durchaus eine hohe Tumorselektivität und damit ein reduziertes Nebenwirkungsspektrum versprechen. Beispiel Tumormetabolismus: Otto Warburg hat bereits in den 1920er Jahren erkannt, dass Krebszellen einen sehr hohen Anteil der Energiegewinnung alleine aus der anaeroben Glykolyse ziehen. Mittlerweile ist man dabei, die massiven metabolischen Unterschiede, die zwischen fast allen Tumorzellen und „normalen“ Gewebszellen bestehen, herauszuarbeiten und mögliche Zielstrukturen für eine Krebstherapie zu validieren.
Auch die Epigenetik, also die Mechanismen, die durch chemische Modifikation die „Ablesung“ des Genoms kontrollieren, kann sich zu einer Goldmine für Kleinmolekül-Targets entwickeln. DNA-modifizierende Enzyme wie Histon-(de)acetylasen und methylasen und ähnliche Proteine werden bereits klinisch bear beitet, aber das volle Potenzial ist sicherlich noch nicht gehoben. Und zu guter Letzt gibt es auch in der boomenden T-Zell Immunonkologie Small Molecule Targets, wie die Indolamin-2,3-Dioxygenase (IDO), die möglicherweise eine gute Ergänzung zu den bereits identifizierten Checkpoints darstellen.
Fazit
Es gibt viele gute Gründe, wissenschaftliche wie ökonomische, auf die Renaissance der Kleinmoleküle in der Krebstherapie zu setzen. Wünschenswert sind neue, breit wirkende und dennoch nebenwirkungsarme Kleinmolekül-Therapien, die nach der Entwicklung dann kosten- und therapieeffizient mit auf anderen Mechanismen beruhenden Medikamenten kombiniert werden können.
ZU DEN AUTOREN:
 |
 |
| Dr. Claus Kremoser | Thomas Hoffmann |
Dr. Claus Kremoser studierte Biochemie in Tübingen und München. Er gründete 2002, zusammen mit Thomas Hoffmann und vier weiteren Kollegen, die Phenex AG , deren Vorstand und CEO er seitdem ist. Hoffmann ist CFO der Phenex AG.
Dieser Artikel ist erschienen in der Ausgabe „Biotechnologie 2017“, die Sie bei uns auf der Seite bequem bestellen oder als E-Magazin lesen können.
Autor/Autorin
Die GoingPublic Redaktion informiert über alle Börsengänge, Being Public, Investor Relations, Tax & Legal, Themen und Trends rund um die Hauptversammlung sowie Technologie – Finanzierung – Investment in den Lebenswissenschaften.


