Klinische Studien sind nicht nur eine notwendige Voraussetzung, um neue Therapien zu den Patienten zu bringen, sie sind ebenfalls wesentliche Werttreiber in der biopharmazeutischen Industrie. Die nachstehend genannten drei Faktoren sind wichtig und sollten für eine erfolgreiche klinische Entwicklung und Wertschöpfung berücksichtigt werden. Von Dr. Diane Seimetz, Biopharma Excellence, und Dr. Jens Peters, Bundesverband der Pharmazeutischen Industrie e.V.
Doch welches sind die drei wichtigsten Faktoren?
- Faktor 1: Aus Scheitern lernen und es beim ersten Mal richtig machen.
- Faktor 2: Wissenschaftlich fundierte Instrumente richtig einsetzen (z. B. adaptive klinische Prüfungsdesigns und Biomarker).
- Faktor 3: Vorbereitet sein auf Änderungen im regulatorischen Umfeld mit erheblichen Auswirkungen auf die klinische Wertschöpfung.
Nachfolgend werden diese Faktoren weitergehend erläutert.
Faktor 1
Laut einer Fallstudie, die von dem US-amerikanischen Ministerium für Gesundheitspflege und soziale Dienste (US Department of Health and Human Services) veröffentlicht wurde[1] kann sich der Wert eines Arzneimittelkandidaten von ca. 60 Mio. USD in der nichtklinischen Phase auf 800 Mio. USD in der konfirmatorischen Phase der klinischen Entwicklung steigern. Im weiteren Verlauf erhöht sich der Wert auf ungefähr 1,3 Mrd. USD zum Zeitpunkt der behördlichen Prüfung des Zulassungsantrages.
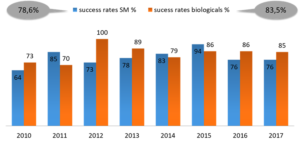
Eine von Biopharma Excellence durchgeführte Analyse ergab, dass über einen Betrachtungshorizont von 8 Jahren hinweg etwa 20% der Zulassungsanträge scheitern (Abb. 2). In den meisten Fällen ist dieses Scheitern auf den klinischen Teil des Dossiers zurückzuführen.
Die zugrundeliegenden Probleme, die zur Ablehnung der Zulassungsanträge führten, wurden tiefergehend untersucht. Basierend auf den Analyseergebnissen werden folgende Maßnahmen vorgeschlagen, um wiederholte Fehlschläge zu vermeiden:
- Erarbeitung einer intelligenten und integrierten Entwicklungsstrategie, d.h. von der Auswahl des Arzneimittelentwicklungskandidaten bis hin zu Strategien für die Zeit nach der Zulassung (Life Cycle Strategie).
- Sicherstellung, dass die Produktentwicklungsrationale Hand-in-Hand geht mit dem angenommenen Wirkmechanismus des Arzneimittels sowie der Pathophysiologie der Erkrankung.
- Herausarbeiten der bestmöglichen klinischen Wirkung der Arzneimittelentwicklungskandidaten – z. B. durch Auswahl der am besten geeigneten Patienten sowie ein optimales Studiendesign mit adaptiven Elementen und Biomarkern.
- Proaktiver Umgang mit Ergebnissen zur Sicherheit und zum Nutzen-Risiko-Profil während des gesamten Entwicklungsprozesses.[1]
Adaptive klinische Studiendesigns und Biomarker sind wichtige Entwicklungsinstrumente, um das Ziel „Auswahl der am besten geeigneten Patienten“ zu erreichen und gleichzeitig mit Unsicherheiten innerhalb des Entwicklungsprozesses eines Arzneimittels umzugehen.
Studien mit adaptivem Design beinhalten die Möglichkeit geplanter, prospektiver Änderungen aufgrund der Ergebnisse von Zwischenanalysen. Somit können das Risiko für Studienteilnehmer und Sponsor auf ein Mindestmaß gesenkt und die gewonnenen Informationen maximiert werden. Bei richtiger Umsetzung erhöht dies deutlich die Erfolgswahrscheinlichkeit und verringert Redundanzen sowie Kosten. So kann die Dauer klinischer Studien der Phase 2 um 40 Tage und der Phase 3 um 47 Tage verringert werden.[2] Die Verwendung adaptiver Studiendesigns hat sich erst während der letzten Jahre langsam durchgesetzt. Folglich ist es möglich, dass sich die Zeitersparnis durch weitere Erfahrungen mit adaptiven Studiendesigns künftig noch vergrößert.
Eine von Biopharma Excellence durchgeführte Analyse hat ergeben, dass für nur 3,7 bis 4,3 % der Arzneimittel, die in den Jahren 2016 und 2017 das zentralisierte Verfahren der EU durchliefen, adaptive Studiendesigns als Teil der klinischen Strategie eingesetzt wurden.

