Über viele Jahre hinweg setzte die Krebstherapie vor allem auf das adaptive Immunsystem. Doch in jüngster Zeit etabliert sich zunehmend die Erkenntnis, dass das angeborene Immunsystem vielversprechende Alternativen bietet. Es ist die erste Instanz bei der Abwehr von Krankheitserregern und spielt auch bei der Bekämpfung von Tumorzellen eine entscheidende Rolle. Insofern dienen die Zellen des angeborenen Immunsystems als interessanter Angriffspunkt, um eine effektive und spezifische Immunantwort gegen den Tumor auszulösen. Die Innate Cell Engager (ICE) sind hier einer der fortgeschrittensten Ansätze, mit ersten vielversprechenden Ergebnissen in klinischen Studien, die hohe Ansprechraten in Patienten mit hämatologischen Tumoren zeigen.
Tumore sind heterogen und anpassungsfähig. Zudem besitzen sie „Fluchtmechanismen“ – sie können sich also unserem Immunsystem entziehen, dessen Aufgabe neben der Abwehr von Krankheitserregern auch die Eliminierung von Tumorzellen ist. Immuntherapien zielen daher darauf ab, das Immunsystem zu aktivieren und die Fluchtmechanismen des Tumors zu schwächen, um ihn anschließend zu zerstören. Vor allem bei hämatologischen Tumoren wird dieser Ansatz verfolgt. Doch auch rund zehn Jahre nachdem Immuntherapien als entscheidender Durchbruch der Krebsbekämpfung gefeiert wurden, profitieren nicht alle Patienten von diesem Potenzial. Die derzeit zugelassenen Therapien helfen nur einem Teil der Patienten nachhaltig. Woran liegt das?
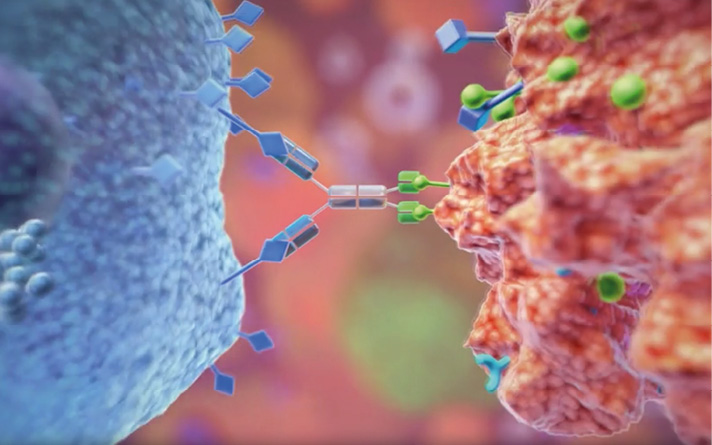
Angeborene Stärke entfesseln: Immuntherapie mit Fokus auf Sicherheit und Wirksamkeit
Die meisten Immuntherapien vernachlässigen bisher das angeborene Immunsystem. Sie konzentrieren sich zu stark auf die Aktivität des adaptiven Systems, obwohl bekannt ist, dass sich beide gegenseitig beeinflussen und ein aktives angeborenes Immunsystem auch die Aktivität des adaptiven Systems stärkt. Zu den Ansätzen mit Fokus auf das adaptive Immunsystem gehören u.a. T-Zell-Therapien wie CAR-T oder bispezifische Antikörper, die an T-Zellen und Tumore binden. Diese verursachen jedoch immer wieder schwere Nebenwirkungen, darunter das Zytokin-Freisetzungssyndrom. Ein Grund hierfür könnte eine verminderte Fähigkeit sein, zwischen gesunden und bösartigen Zellen zu unterscheiden, wie es bei CD3-T-Zell-Engagern mitunter der Fall ist. Der Einsatz von Zellen des angeborenen Immunsystems, natürlichen Killerzellen (NK-Zellen) und Makrophagen, könnte diese Sicherheitsrisiken durch ihre Spezifität minimieren.
Natürliche Killer im Rampenlicht
Dieses Potenzial wurde inzwischen auch von zahlreichen Biotechnologieunternehmen erkannt, die sich nun auf die Entwicklung entsprechender Therapien konzentrieren. Viele dieser Ansätze befinden sich allerdings noch in der präklinischen oder frühen klinischen Forschung. Dabei hat sich gezeigt, dass der Einsatz von NK-Zellen aufgrund ihrer natürlichen Fähigkeit, Krebs zu eliminieren, und ihrer entscheidenden Rolle bei der Immunüberwachung den vielversprechendsten therapeutischen Ansatz darstellen. NK-Zellen sind dazu in der Lage, Oberflächenproteine abnormaler Zellen zu erkennen, wodurch diese sich von normalen Zellen unterscheiden. Sobald NK-Zellen eine abnorme Zelle erkennen, setzen sie zytotoxische Moleküle frei, die die Tumorzellen zerstören. Zu den derzeit gängigen Entwicklungsansätzen für die Patientenbehandlung gehören die Ergänzung gesunder NK-Zellen oder, analog zu CAR-T, CAR-NK-Zelltherapien sowie bi- oder multispezifische Antikörper, die NK-Zellen mobilisieren. Bispezifische Antikörper können zwei Antigene über spezifische Rezeptoren binden, wodurch sie eine Art Brücke zwischen den NK-Zellen und den Tumorzellen bilden, sodass die NK-Zellen aktiviert werden und den Tumor bekämpfen.
Bispezifische Antikörper – alte Konzepte neu interpretiert
Diese Idee ist bereits seit 60 Jahren bekannt, sie konnte aber lange Zeit aufgrund vielerlei Hürden in der Herstellung nicht umgesetzt werden. Heute nutzen Unternehmen wie GT Biopharma, INNATE PHARMA, Dragonfly Therapeutics und Affimed eine Handvoll NK-Zell-spezifischer Rezeptoren wie CD16, NKp46 und NKG2D für die Entwicklung von Therapien. Diese werden dann mit verschiedenen tumorspezifischen Zielstrukturen kombiniert und gegen den Krebs eingesetzt.
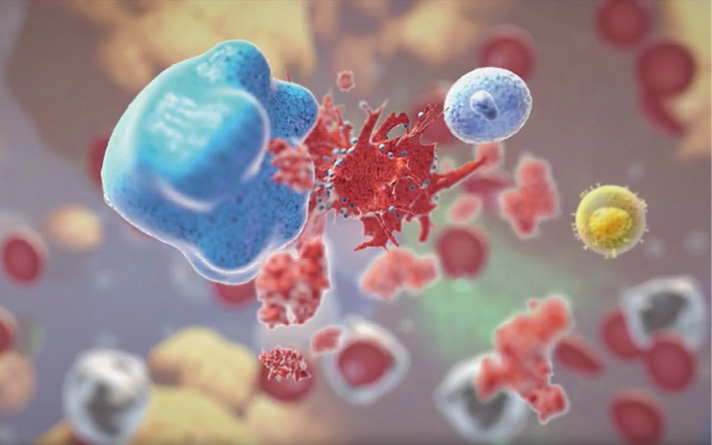
Innate Cell Engager mit ersten entscheidenden Erfolgen im Feld
Tetravalente, bispezifische Antikörper, sogenannte Innate Cell Engager (ICE), wie sie von Affimed entwickelt wurden, binden an CD16a, einen der bedeutendsten Rezeptoren zur Aktivierung von NK-Zellen. Neben NK-Zellen können ICE-Moleküle auch Makrophagen aktivieren, die Fresszellen unseres angeborenen Immunsystems. Außerdem wirken sie indirekt auf das adaptive Immunsystem, wodurch sie die Immunantwort weiter verstärken. Affimed ist einer der Vorreiter auf dem Gebiet der Krebstherapie über das angeborene Immunsystem und hat sich auf die Entwicklung von ICE spezialisiert. Der am weitesten entwickelte Produktkandidat ist AFM13, der einerseits an CD16a und andererseits an CD30 bindet. CD30 ist ein Protein, das vermehrt auf einer Untergruppe von aktivierten T- und B-Lymphozyten in Tumoren vorkommt, deren Behandlung nicht immer auf gängige Therapien anschlägt. Im ersten Ansatz wird AFM13 in Patienten mit refraktären oder rezidivierten CD30-positiven Hodgkin-Lymphomen untersucht, die alle alternativen Therapieoptionen ausgeschöpft haben; ebenso bei Patienten mit schwer therapierbaren Non-Hodgkin-Lymphomen. Dazu gehören u.a. CD30-positive periphere
T-Zell-Lymphome (PTCL), deren Fünf-Jahres-Überlebensrate unter 30% liegt.
AFM13 erzielte in einer klinischen Phase-I/II-Studie in Zusammenarbeit mit dem MD Anderson Cancer Center bereits herausragende Ergebnisse in Patienten mit CD30-positiven Lymphomen. Da einige Krebspatienten nicht über genügend funktionsfähige NK-Zellen verfügen, wurde AFM13 im Rahmen dieser Partnerschaft mit NK-Zellen vorkomplexiert und den Patienten verabreicht. Affimed verzeichnete bei dieser Studie eine Ansprechrate von 94% bei Patienten, die mit der empfohlenen Phase-II-Dosis behandelt wurden, sowie eine komplette Ansprechrate von 71%. Basierend auf diesen Daten hat Affimed nun zusammen mit Artiva eine neue Phase-II-Studie gestartet, um diesen Ansatz für eine möglichst breite Patientenpopulation im Bereich der CD30-positiven Lymphome verfügbar zu machen.
Die nächste Erfolgsgeschichte der Immuntherapie etablieren
Das angeborene Immunsystem ist noch ein junges Feld in der Krebsimmuntherapie, aber die ersten klinischen Ergebnisse zeigen, dass mit diesem Ansatz in der richtigen Kombination ein großer Mehrwert für Patienten generiert werden kann. Diese vielversprechenden Fortschritte markieren einen bedeutsamen Schritt in der Evolution der Krebsbehandlung. Indem wir die Stärke des angeborenen Immunsystems nutzen und sie mit bewährten adaptiven Therapien integrieren, eröffnen sich völlig neue Perspektiven für eine umfassende und wirksame Tumorabwehr. Dies könnte nicht nur die nächste Erfolgsgeschichte in der Immuntherapie sein, sondern auch einen Weg ebnen, die Behandlung von Krebs über verschiedene Indikationen hinweg nachhaltig zu verbessern. Die Synergie zwischen der natürlichen Immunität und modernen therapeutischen Ansätzen könnte den Wettlauf gegen den Krebs neu definieren und eine Ära bahnbrechender Behandlungschancen einläuten.
Autor/Autorin

Dr. Arndt Schottelius
Dr. Arndt Schottelius ist Chief Scientific Officer bei Affimed mit über 25 Jahren Erfahrung in der biopharmazeutischen Forschung und Entwicklung. Vor seiner Zeit bei Affimed war er Executive VP & Head Research & Development bei Kymab Ltd, Chief Development Officer der MorphoSys AG und Medical Director Immunology Development bei Genentech, Inc. Der Experte für angeborene Immunität promovierte an der Universität Freiburg.


